|
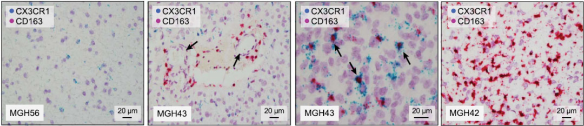
发不了大文章?可能是姿势不对2017年4月,Science上发表了一篇题为“Decoupling genetics, lineages, and microenvironment in IDH-mutant gliomasby single-cell RNA-seq”的文章。该文章通过单细胞RNA原位杂交发现,星形细胞瘤和少突神经胶质瘤这两种脑癌竟来自同一种神经前体细胞。 之前已有研究发现了促进肿瘤生长的基因突变,并根据包含肿瘤细胞和微环境中正常细胞的组织样品基因表达分析对肿瘤进行了分类。但是由于这些分析都是对全肿瘤组织进行的,因此可能掩盖了许多重要的信息。 在本研究中,研究人员通过将来自10个星形细胞瘤的9800个细胞和6个少突神经胶质瘤的4300个细胞的单细胞RNA测序结果与癌症基因组图谱中的165个全肿瘤测序结果进行对比,结果显示,两种肿瘤都包含三种不同的癌细胞:分化成星形胶质样或少突细胞样的不增殖细胞以及与神经干细胞相似的可以促进肿瘤生长的细胞。很多在全肿瘤测序中显示出的星形细胞瘤和少突胶质细胞瘤的RNA表达差异都是由TME而非恶性细胞表达谱产生的。两种肿瘤的差别似乎主要由遗传物质的差别和肿瘤微环境组成的差别决定,如肿瘤微环境中不同的免疫细胞的数量差别。在胶质瘤微环境中,小胶质细胞表达谱与巨噬细胞的表达谱处于渐进性而非截然分开的状态,提示了在胶质瘤中微环境驱动巨噬细胞特性减低,而小胶质细胞表达谱增加的趋势。 在这篇文章中,单细胞RNA原位杂交这一技术立了大功:
除此之外,4月在Cell子刊Neuron上也发表了2篇使用这一技术的文章。 一篇题为Genetically Distinct Parallel Pathways in the Entopeduncular Nucleus for Limbic and Sensorimotor Output of the Basal Ganglia的文章研究了基底神经节脚内核的分类及功能。研究人员进行了大量原位检测完成了对脚内核的神经传入和投射的研究,在脑片中原位检测并定量了小鼠的多个RNA。通过使用单细胞转录和分子分析发现脚内核(EP)含有至少三类投射神经元,包括谷氨酸/GABA共同释放生长抑素性神经元,谷氨酸能小清蛋白神经元,和GABA能小清蛋白神经元。 另一篇题为Basolateral to Central Amygdala Neural Circuits for appetitive Behaviors的文章研究了杏仁基底外侧核(BLA)到中间核的神经回路与摄食行为。研究者使用了RNAscope原位杂交方法对多个目标RNA在该核团内的分布进行了原位检测。通过检测,该研究团队在中央杏仁核(CeA)区域鉴别出一些基因迥异的CeA神经元群体可以介导摄食行为,并对参与摄食行为的杏仁基底外侧核到中央杏仁核的神经回来进行了解剖。发现蛋白磷酸酶1调节亚单位1B阳性的BLA锥体神经元到多巴胺能受体1阳性的CeA神经元构成的通路可以促进摄食行为,然而R-spondin 2阳性的BLA锥体神经元到多巴胺能受体2阳的CeA神经元构成的通路参与抑制摄食行为。 帮助这些文章顺利完成的关键技术——RNAscope原位杂交技术到底是个啥? RNAscope?专利技术是近年来新兴的RNA原位杂交技术,是RNA原位杂交(ISH)领域的一项重大进步。它由Advanced Cell Diagnostics公司(Newark, CA)开发,通过专利的双“Z”探针设计和信号放大系统,能够在单细胞水平同时定量多个RNA的表达,在获得单细胞中单拷贝RNA表达数据的同时提供完整的组织形态学信息。 传统的RNA原位杂交有Isotopic ISH、非-ISOTOPIC ISH和直接法RNA原位杂交等。由于缺乏敏感性和特异性,这些RNA原位杂交一直受到较大的限制。 RNAscope 方法作为新一代的RNA原位杂交技术,与传统的RNA原位杂交方法相比,灵敏度提高至少100倍,还有更多优势:
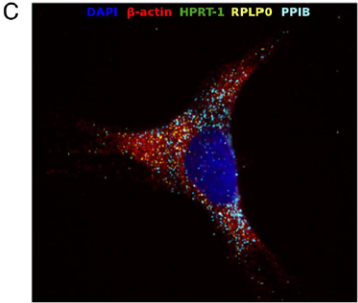
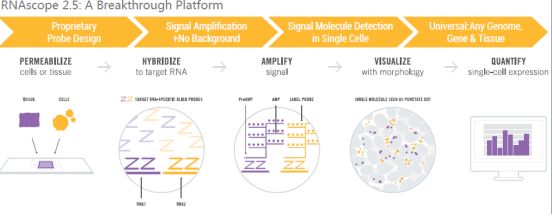
图注:使用RNAscope Multiplex Assay检测小鼠Hela细胞石蜡包埋切片中四个基因mRNA的表达,DAPI染核。 RNAscope 方法克服了以前的RNA原位杂交技术的非特异性杂交、灵敏度低、对样本要求高等弱点,可替代传统的ISH/FISH RNA 原位检测,同时单分子检测灵敏度提供了在组织细胞原位对单个细胞中基因的表达进行检测,释放RNA作为生物标记的全部潜能,提高对疾病与标志物之间复杂的生物学相关性的认识,是理想的能够用于NGS和芯片技术后期转化研究技术平台。 RNAscope原位杂交步骤:
Step 1:透化:通过RNAscope预处理试剂盒处理载玻片上固定好的组织或细胞,暴露目标RNA。 Step 2:探针杂交:针对靶基因设计RNAscope专利Z型探针与目标RNA杂交。 Step 3:信号放大:RNAscope检测试剂盒逐级信号放大。 Step 4:信号可视化:在普通光学显微镜或者多光谱荧光成像系统下,每一个目标RNA分子以一个点状信号的形式呈现。 Step 5:量化分析:显微镜下直接计数或者使用图像分析软件如RNAscope? SpotStudio? 或HALO对每一个细胞中的RNA单分子信号进行精确定量分析。 RNAscope的应用领域很广,抗体能用到的地方都可以用;找不到合适抗体的实验,更要选择RNAscope。从2011年开始至今,目前已经有800多篇相关文献发表[这个地方可以放一个“点击可下载已发表的文献列表”,然后把一个pdf的文献列表发在这里供下载吗?而且,凡是下载的人的信息可以统计收集。 如果您想要更深入地了解RNAscope技术,了解其原理和使用实例,那么福利来了——我们精心准备了一个webinar!来自中国科学院生物物理所实验动物病理表型分析平台的郝俊峰教授,将给大家带来精彩的RNAscope技术科研实例报告。快来一起学习吧! 在这里你可以了解到: webinar地址:http://webinar.b.bioon.com.cn/live-info/acd_webinar3.html 试验技术的选择对试验效率和结果的影响至关重要,希望大家在设计实验的过程中充分考虑技术方法的选择,少走弯路,并收获理想的成果! |