|
抗癌神药PD-1/L1研究火热 国内外企业加速布局如果上百家企业针对同一个靶点或是同样的产品做研究,是高水平的重复,企业要从自身优势出发,结合市场,冷静判断再做研究和研发。”近日,第一届“复旦-中植科学奖”将奖项颁给了美国免疫学家詹姆斯·艾利森(James Allison)以及日本免疫学家本庶佑(Tasuku Honjo),表彰二人“在人类肿瘤免疫治疗方面做出的杰出贡献”。 尽管随后有媒体和学者质疑奖项遗漏了“在该领域作出同样杰出贡献的华人免疫学家、耶鲁大学肿瘤免疫中心主任陈列平”,暂不论此学术争议,不可否认的是,近年来以PD-1抗体为代表的肿瘤免疫治疗成为业内新宠,越来越多的国内外科学家及制药公司正在不断加码相关研究。
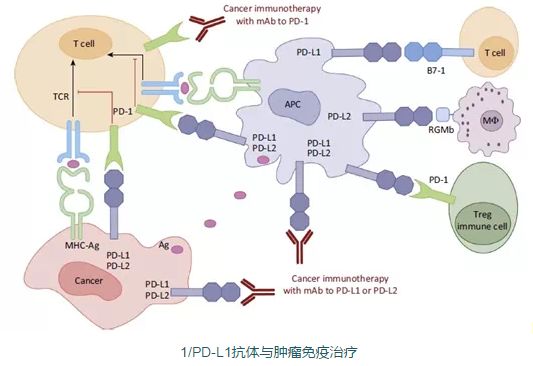
根据全球最大的临床试验注册库美国ClinicalTrials.gov统计数据显示,登记在册的PD-1/L1相关临床试验超过400个。 目前PD-1抗体获得FDA批准用于治疗晚期黑色素瘤、非小细胞肺癌、肾细胞癌、头颈癌和霍奇金淋巴瘤五大肿瘤的适应症。已经上市的PD-1抗体包括默沙东的Keytruda和BMS的Opdivo,罗氏的PD-L1抗体Tecentriq获批用于治疗晚期的膀胱癌和非小细胞肺癌。 鉴于PD-1抗体等特异性免疫治疗药物的出色疗效,市场亦给予了极高的预期,据EvaluatePharma预测,2020年全球免疫检查点抑制剂市场规模为350亿美元。 而创新药物的开发一向高风险、高利益并存。2016年8月,百时美施贵宝(BMS)宣布其PD-1抑制剂Opdivo(nivolumab)在针对晚期非小细胞肺癌的终期实验中数据折戟,被业内视为其竞争对手默沙东的机遇。 “在新药研发中,临床的设计方案很大程度上决定了药物的成败,这对国内火热的研发企业是一个借鉴和警示。”中科院上海药物研究所研究员沈竞康在接受21世纪经济报道记者时表示:“一方面国内有数百家企业投入到PD-1/L1研发中,紧跟国际研发、缩短与国际的差距是好事;另一方面也要反思,如果上百家企业针对同一个靶点或是同样的产品做研究,是高水平的重复,企业要从自身优势出发,结合市场,冷静判断再做研究和研发。” “神药”PD-1/L1 2016年美国临床肿瘤学会(ASCO)年度研究进展报告中将免疫治疗评为2015年癌症研究领域的最大进展。 目前,肿瘤免疫治疗较成功的领域及研究的热点主要集中在“免疫检查点抑制剂”,不同于传统化疗和靶向治疗,原理是通过克服患者体内的免疫抑制,重新激活患者自身的免疫细胞来杀伤肿瘤,是一种全新的抗肿瘤治疗理念。 人体免疫系统中主要的“抗癌战士”称为“T细胞”,其表面有不同功能的受体,类似“油门”与“刹车”,被称为“检查点阻断剂”的药物可以松开刹车踩油门,与肿瘤作战。PD-1是其中的关键,作为一种细胞膜蛋白受体,正常情况下其功能是抑制T细胞的激活,这是免疫系统的一种正常的自稳机制。 但许多肿瘤细胞利用这一点,让“刹车”一直工作,使T细胞功能被抑制,PD-1的抗体则可以阻断这一通路,使这些细胞能够继续杀伤肿瘤细胞。 在FDA批准的用于治疗黑色素瘤和肺癌的检查点阻断剂中,Yervoy(ipilumunab)阻断CTLA-4的检查点,另外两个Opdivo和Keytruda的药物则阻断PD-1的检测点,研究表明,许多肿瘤对检查点阻断剂有反应。 上述两位获奖的科学家,詹姆斯·艾利森为美国德克萨斯大学安德森癌症中心教授,首次发现阻断CTLA-4能够激活免疫系统的T细胞攻击癌细胞,同时研发出世界上第一种用于免疫-肿瘤疗法的CTLA-4抗体,后联合BMS研发成为ipilimumab。 James Allison在接受21世纪经济报道记者采访时表示,“现在所谓检查点的阻截技术,已经成为癌症治疗的一个比较新的领域,实际上有很多种不同的分子,都能够对癌症起到作用。目前许多医药公司都在临床进行了大量的病患治疗和研究,比如BMS和默沙东都有自己的计划,不管是CTLA-4还是PD-1都是我们值得关注的点位。” PD-1受体则是由另一位获奖者本庶佑于1992年发现,而PD-L1配体则由中国科学家陈列平教授于1999年发现。 本庶佑首次发现PD-1是激活T淋巴细胞的诱导基因,其后续研究揭示了PD-1是免疫反应的负调节因子。对PD-1的发现以及相关研究为后续进一步成功发展PD-1抗体奠定了基础,其中包括纳武单抗(Nivolumab)以及派姆单抗(Pembrolizumab)。 此前牛津大学临床医学系肿瘤生物学教授、英国医学院院士卢欣曾对媒体评价陈列平的工作:“陈列平克隆了PD-L1,可以和PD-1结合,他第一个证明PD-L1和PD-1结合以后有免疫抑制的作用。他也是第一个证明可用抗体抑制PD-L1,抑制肿瘤生长的科学家。” 本庶佑在获奖发言时对于PD-1疗效给出了高度的肯定,“我们现在几乎已经站在了打开治疗肿瘤的通道大门之前,很快就可以发现能够治疗肿瘤的、类似盘尼西林类的药物。PD-1的发现相当于在传染性疾病或细菌性疾病里面发现了青霉素一样重要。也许在接下来的二十年时间里面,癌症将不再会成为人类的一个主要死因。” 国内企业加码 EvaluatePharma近日发布《EP Vantage 2017 Preview》报告,对2017年全球销售额TOP10药品、2017年可能获批上市的前十大重磅药物进行了预测。 在2017年销售收入十大制药公司中,辉瑞通过大手笔收购,2017年仍将领跑。罗氏的增长将主要归功于PD-L1药物Tecentriq,默沙东Keytruda将是2017年增长最快速的药品。 以目前的市场表现和可预见到广阔前景,目前制药企业和资本对于PD-1/L1等抑制剂的追捧持续升温。以目前获批在美国上市的药物为例,Opdivo(PD-1抗体)单价为28.78美元/毫克,Yervoy单价157.46美元/毫克,患者平均每年的治疗费用在15万~25万美元之间。Keytruda(PD-1抗体)用于非小细胞肺癌、黑色素瘤等,每年费用约15万美元。罗氏的Tecentriq(PD-L1抗体),用于治疗膀胱癌,每年费用约15万美元。 从已经上市的药品销售业绩来看,Ipilimumab上市四年间取得13.08亿美元/年的销售额,复合增速38%;EvaluatePharma预测2014年9月上市的Pembrolizumab销售额未来有望达到40.6亿美元。 国外药企有百时美施贵宝、默沙东、辉瑞、阿斯利康、GSK等制药巨头纷纷入场,多款针对不同免疫检查点的药物正在临床试验中。国内几大制药公司如恒瑞医药、君实生物、百济神州等,分别获得了重组人源化抗PD-1单克隆抗体注射液、BGB-A317注射液和注射用SHR-1210的临床批件,以及一些新兴的生物制药企业如信达生物,均在布局和开展相关的临床试验。 根据CFDA数据显示,目前国内暂无抗PD-1单克隆抗体获批生产。BMS提交了8项Nivolumab注射液的进口临床申请,部分已获临床批件。默沙东提交了9项Pembrolizumab注射液的进口临床申请,均已“制证完毕,已发批件”。 2016年11月底,康宁杰瑞和思路迪宣布KN035重组人源化PD-L1单域抗体Fc融合蛋白注射液通过美国FDA审评,获准开展临床研究,据悉这是首个由中国企业自主研发、在美进入临床的抗体类创新药。 面对如此火热的市场,沈竞康认为企业有无核心竞争力要明确几个要素:“最重要的要确认时间,自己是不是在第一梯队;二是要有自己产品独特性,在跟踪性研发中也要有创新;三是质量;四是企业定位和自身的产品线组合。” 而鉴于免疫检查点抑制剂的作用机理、应答方式,会导致一些独特的、与免疫相关的不良反应及毒副作用。“在紧跟国际研发的同时要注意临床需求和病人的差异性,要提高患者的认知度,对患者进行分群,不同的患者使用不同的治疗方式和药物。神药并不是包治百病,要推进精准医疗和个性化治疗,减少盲目浪费。” |